Endoskopik reflü tedavisi, daha büyük bir antireflü cerrahisi geçirmek istemeyen veya uzun süreli ilaç kullanmak istemeyen kronik semptomları olan hastalarda gastroözofageal reflü hastalığının tedavisi için minimal invaziv bir seçenek sunar.
Transoral insizyonsuz fundoplikasyon, yani ağızdan girilerek, karında kesi olmadan gerçekleştirilen reflü tedavisi, laparoskopik fıtık onarımı ile birlikte olsun ya da olmasın, uzun vadeli yan etkiler (hazımsızlık, şişkinlik ve gaz gibi) olmaksızın antireflü cerrahisine en yakın seçeneği sunar.
Transoral insizyonsuz fundoplikasyon ve bazı durumlarda Stretta için kanıtların artmasıyla birlikte, güncellenmiş kılavuzlar bu prosedürleri seçilmiş hasta popülasyonları için önermeye başlamıştır.
Alt özofagus , yani yemek borusunun alt ucundaki büzücü kasları güçlendiren cihazlar ve teknikler, geleneksel işlemlerin uygulanmasının zor olduğu seçilmiş hasta popülasyonlarında (örn. değişmiş anatomi) potansiyel bir role sahip olabilir, ancak etkinlik ve güvenliklerinin daha iyi değerlendirilmesi için yüksek kaliteli kanıtlara ihtiyaç vardır.
Gastroözofageal reflü hastalığı (GÖRH), özellikle işlenmiş gıdalarla beslenmeye bağlı olarak Batı dünyasında sıklığı giderek artan en yaygın kronik hastalıktır. İlaçla tedaviye rağmen, hastaların önemli bir kısmı bezdirici belirtileri yaşamaya devam etmekte ve böylece minimal invaziv GÖRH tedavi seçeneklerine olan talebi artırmaktadır.
Endoskopik tedavilerin güvenliği ve etkinliğine dair kanıtların artmasıyla birlikte, son kılavuzlar ve fikir birliği topluluğu belgeleri GÖRH’nin endoskopik tedavisine yönelik önerilerini güncellemiştir. Bu derlemede, GÖRH tedavisi için endoskopik yaklaşımların mevcut durumunu kapsamlı bir şekilde değerlendiriyor ve gelecekteki yönelimlere göz atıyoruz.
GÖRH için endoskopik tedaviler, yeni tedaviler ortaya çıktıkça ve mevcut tedaviler daha güvenli ve daha tekrarlanabilir seçeneklere dönüştükçe umut vaat etmektedir. Bu minimal girişimsel işlemler kronik GÖRH durumundan muzdarip nüfusun büyük bir bölümüne hitap etmektedir.
Giriş
Gastroözofageal reflü hastalığı (GÖRH), hastaların yaşam kalitesini önemli ölçüde etkileyebilen kronik bir durumdur. Tipik (örn. mide ekşimesi, regürjitasyon, yani asit ve gıdaların ağza gelmesi, şişkinlik) ve atipik (örn. öksürük, ses kısıklığı, solunum güçlüğü) GÖRH semptomları ile ortaya çıkabilir. GÖRH sıklığı küresel olarak değişmekle birlikte yıllar içinde artış göstermektedir. Nüfus temelli çalışmaların sistematik bir incelemesi, GÖRH prevalansının Kuzey Amerika’da %15,4, Orta Amerika’da %19,6, Güney Amerika’da %17,6, Güney Avrupa’da %21,3, Kuzey Avrupa’da %15,5, Avustralya’da %14,1, Orta Doğu’da %15, Güney Asya’da %22,1 ve Güneydoğu Asya’da %7,4 olduğunu göstermiştir[1]
Yaşam tarzı değişiklikleri ve tıbbi tedavi GÖRH için ilk basamak tedavidir. Proton pompa inhibitörleri (PPI) mide asidini azaltıcı etkileriyle medikal tedavinin temel taşıdır. Bununla birlikte, kronik GÖRH hastalarının büyük bir kısmı medikal tedaviye dirençli kalmaktadır.[2] Ayrıca, uzun süreli medikal tedaviye aday olmalarına rağmen, bu tedaviyi sürdürmeye meyilli olmayan ek bir hasta alt grubu da bulunmaktadır. Öte yandan, antireflü cerrahisi (ARS) kronik/dirençli GÖRH hastalarında etkinlik göstermiştir, ancak daha invazivdir ve disfaji, kontrolsüz şişkinlik ve gaz şişkinliği gibi uzun vadeli yan etkilerle ilişkilidir.[3,4] Endoskopik minimal invaziv GÖRH tedavisi, tıbbi tedavi ile ameliyat arasındaki bu boşluğu doldurma potansiyeline sahiptir.
Endoskopik tedavinin etkinliği ve güvenliğine ilişkin kanıtların yıllar içinde artmasıyla birlikte, ARS ile ilgili en son kılavuz önerilerine dahil edilmiştir. Bu derlemenin amacı, endoskopik tedavilerin mevcut durumunu özetlemek ve gelecekteki yönelimleri vurgulamaktır. Bu yöntemleri tek tek inceleyeceğiz.
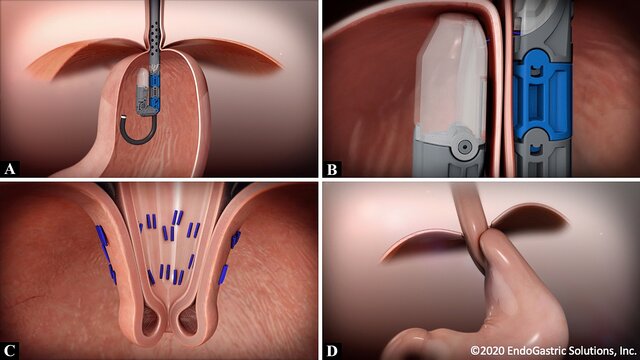
TIF: Transoral İnsizyonsuz Fundoplikasyon
Transoral insizyonsuz fundoplikasyon (TIF), EsophyX cihazı (EndoGastric Solutions, Redmond, WA) kullanılarak gerçekleştirilen minimal invaziv bir endoskopik fundoplikasyon tekniğidir. İlk olarak 2007 yılında onaylanmıştır ve o zamandan beri cihaz ve prosedür yıllar içinde gelişmiştir. Mevcut prosedür ve cihaz versiyonları sırasıyla TIF 2.0 ve EsophyX-Z’dir. TIF anatomik ve fizyolojik olarak cerrahi fundoplikasyona benzer. TIF, diyaframın altına çekilen ve polipropilen bağlantı elemanları ile tutturulan distal özofagusun, yani yemek borusu alt ucunun etrafında 2-4 cm uzunluğunda mide fundusunu yukarı doğru katlayarak tam kalınlıkta bir gastro-gastrik plikasyon, yani mürekkep hokkasına benzer bir yeni kapak oluşturur.
270-300° fundoplikasyon oluştururken, cihazın çapı lümen çapını kontrol ederek aşırı sıkmayı önler. Bu, gazın özofagustan hala kaçmasına izin vererek işlem sonrası gaz-şişkinliği en aza indirir. Avrupa’da 5 yıllık randomize, açık, paralel grup çalışması olan LOTUS çalışmasında ARS ile medikal tedaviye kıyasla daha sık disfaji, şişkinlik ve gaz bildirilmiştir[4].
Üç randomize kontrollü çalışmanın meta-analizi, TIF’in tedavi görmeyen grup veya PPI ile karşılaştırıldığında GÖRH için objektif (özofageal pH’da azalma) ve subjektif (PPI kullanımında azalma, hasta memnuniyeti ve yaşam kalitesinde iyileşme) parametreleri iyileştirdiğini göstermiştir.[10-13] Randomize kontrollü bir çalışma olan TEMPO çalışmasından elde edilen 5 yıllık veriler ve 2021 yılında Testoni ve arkadaşları tarafından yapılan bir meta-analizden elde edilen uzun vadeli veriler, prosedürün dayanıklılığına dair kanıtlar sunmaktadır.[14,15] Ayrıca, TIF’in etkinliği karşılaştırmalı olmayan birçok çalışmada değerlendirilmiştir.[16-23]
TIF’in tüm serilerdeki uygulamaları için birleştirilmiş ciddi yan etki oranı %2 ila %2,5 arasında değişmektedir.[24,25] Bununla birlikte, yan etki profilini doğru bir şekilde değerlendirmek için farklı cihazları ve teknikleri gruplandırmamak önemlidir. TIF 2.0 tekniğinin piyasaya sürülmesinden bu yana, ciddi istenmeyen olaylar yaklaşık %0,4-1’e düşmüştür.[26-28] ARS ile TIF’i doğrudan karşılaştıran yüksek kaliteli veriler yetersizdir. Analizin yöntemi konusunda endişeler dile getirilmiş olsa da, TIF ile laparoskopik Nissen fundoplikasyonu (LNF) veya PPI’yi karşılaştıran bir çalışma, LNF’nin asit maruziyetini azaltma olasılığının daha yüksek olduğunu göstermiştir. Karşılaştırıldığında, TIF’in subjektif semptomları iyileştirme olasılığı daha yüksekti.[29] Mevcut kanıtların gözden geçirilmesinden, TIF’in GERD’li seçilmiş hastalarda güvenli, etkili ve dayanıklı olduğu sonucuna varmak mümkündür.
Genel olarak, TIF için ideal adaylar, 2 cm’den fazla hiatal herni yani mide fıtığı defekti olmayan, alt özofagus sfinkter yetersizliği şiddetli olmayan (Hill derece II veya daha az) ile doğrulanmış GÖRH tanısı olan hastalardır. İdeal adaylığın hastaların büyük bir kısmını kapsamadığı göz önüne alındığında, Hill derecesi >2 ve hiatal herni boyutu >2 cm olan hastalar için TIF sonrası tekrarlayan semptomlara ilişkin endişeleri de ele alan TIF ile eşzamanlı hiatal herni onarımı (cTIF) tanıtılmıştır.[21,30,31]
2017 yılında FDA, TIF cihazının kullanım talimatlarında değişiklik yapılmasına izin vererek TIF’in cerrahi fundoplikasyona benzer şekilde hiatal herni onarımı ile birlikte uygulanmasına izin vermiştir. Tipik ve atipik GÖRH semptomları için cTIF prosedürlerinin güvenliği ve etkinliğine dair kanıtlar giderek artmaktadır.[26,32-34] Jaruvongvanich ve arkadaşları tarafından yakın zamanda yapılan bir çalışmada, hiatal herni onarımının ardından LNF ile cTIF karşılaştırılmış ve iki grup arasında işlem sonrası PPI kullanımı, disfaji, özofajit, bozulmuş sargı ve hiatal herni nüksü açısından karşılaştırılabilir sonuçlar elde edilmiştir. Daha da önemlisi, çalışmada hastanede kalış süresi, tekrar başvuru oranı, erken advers olay oranı, ciddi advers olay oranı ve şişkinlik veya başlangıçtaki şişkinliğin kötüleşmesi insidansının cTIF’li hastalarda HH onarımını takiben LNF’ye kıyasla daha düşük olduğu bulunmuştur[35].
TIF Prosedürünün Geleceği:
TIF’in primer GÖRH için mevcut endikasyonuna ek olarak, diğer klinik ortamlarda da araştırılmaktadır. İlk olarak, akalazya tedavisinde kullanılan per-oral endoskopik miyotomi (POEM) sonrası GÖRH tedavisini içermektedir. İlk fizibilite beş ve ardından üç hastada gösterilmiş olup, yazarlar TIF sonrası PPI kullanımında ve özofajitte ciddi bir yan etki ve sonuç olarak azalma tespit etmemişlerdir.[36,37] Gelecekteki araştırmaların ikinci alanı ekstraözofageal GÖRH veya atipik GÖRH semptomları olan hastalardır. Bu hastalarda ARS’nin etkinliği değişkendir ve PPI tedavisine yanıt alınamaması ARS’ye yanıt alınamamasının öngörüsü olarak kabul edilmektedir.[38-40] TIF bu hasta popülasyonunda atipik GÖRH’nin subjektif semptomlarını azaltmada etkinlik bulmuştur.[26] Bu iki uygulamayı incelemek için klinik çalışmalar devam etmektedir.
GÖRH ve obezite hastalarında, Shah ve arkadaşları[41] aynı seansta TIF ve ardından endoskopik sleeve gastroplasti (ESG) vakasını başarıyla göstermişlerdir. Bir başka uygulama da laparoskopik tüp mide ameliyatı (LSG) geçirecek obezite hastalarıdır. TIF, mide fundusunun çoğunu fundoplikasyona dahil etmez, bu nedenle LSG’den önce yapılabilir. Bu uygulamayı incelemek için klinik çalışmalar devam etmektedir. Öte yandan, kalan fundus prosedür için yeterli olmayabileceğinden, TIF LSG sonrası teknik olarak zorlayıcı olabilir. Son olarak, standart Nissen Fundoplikasyonu ile karşılaştırıldığında, TIF özofagus motilitesi bozulmuş hastalarda uygulanabilir.[43,44] Bu, TIF’in akciğer nakli sonrası GÖRH hastaları için değerlendirilmesinin nedenlerinden biridir.[45]
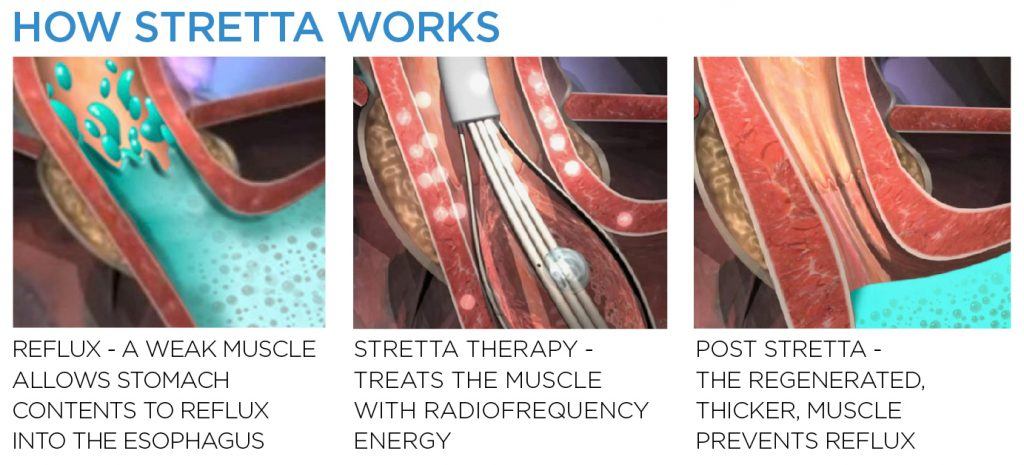
Radyofrekans Antireflü Prosedürü (Stretta)
Stretta cihazı (Restech, Houston, TX) 2000 yılında GÖRH için endoskopik bir tedavi olarak FDA onayı almıştır. O tarihten bu yana 25.000’den fazla prosedür gerçekleştirilmiştir. Stretta sistemi, yeniden kullanılabilir bir radyofrekans (RF) jeneratörü ve tek kullanımlık bir RF kateteri içerir. Kateter, bir endoskop kullanılarak gastroözofageal kavşağın (GEJ) mesafesi ölçüldükten sonra bir kılavuz tel yardımıyla yemek borusu-mide bileşkesine sokulur ve konumlandırılır. Kateter, şişirildikten sonra iğne elektrotları yemek borusunun kas tabakasına uzatan bir balon sepetine sahiptir. Elektrotlar alt özofagus sfinkterine (LES) radyofrekans enerjisi uygular. Radyofrekans enerjisinin verilmesi özofagus içinde ve mide kardiyasında dört seviyede gerçekleşir. Prosedür boyunca, mukozal kaplamanın zarar görmesini önlemek için RF jeneratöründeki entegre bir irigasyon pompası aracılığıyla yıkama için sabit bir soğutulmuş su akışı kullanılır. Etki mekanizması tam olarak anlaşılamamıştır, ancak RF enerjisinin LES ve mide kardiyasına uygulanmasıyla doku uyumunu ve alt özofageal sfinkter gevşemesini azalttığı öne sürülmektedir[46].
Sistematik incelemeler ve meta-analizler Stretta prosedürünün etkinliğine ilişkin çelişkili bulgular ortaya koymuştur. 2015 yılında Lipka ve arkadaşları[47] özellikle randomize kontrollü çalışmaları incelemiş ve Stretta’nın özofageal asit maruziyeti, yaşam kalitesi veya proton pompası inhibitörlerini (PPI) bırakma becerisinde önemli değişikliklere yol açmadığını bildirmiştir. Buna karşılık, 2017 yılında Fass ve arkadaşları[48] hem randomize kontrollü çalışmaları hem de kohort çalışmalarını meta-analiz etmiş ve Stretta’nın LES bazal basıncı dışında GÖRH hastaları için hem öznel hem de nesnel sonuçları iyileştirdiği sonucuna varmıştır. Bununla birlikte, uzun vadeli gözlemsel veriler, 8-10 yıl boyunca yaşam kalitesini iyileştirmek ve PPI kullanımını azaltmak için prosedürün dayanıklılığını göstermiştir[49,50] Stretta, antireflü prosedürleri arasında en güvenli ve uygulanması en kolay olanlardan biri olarak kabul edilir. Sistematik bir incelemede, gerçekleştirilen 2468 Stretta prosedürü arasında yan etki oranı %1’den az bulunmuştur[48].
Fundoplikasyon mu Stretta mı?
Fundoplikasyona kıyasla Stretta’nın uygulanması nispeten daha kolaydır ve tutarlı bir tekrarlanabilirliğe sahip olabilir. Cerrahi anatomiyi önemli ölçüde etkilemez, bu da yetersiz yanıt veren hastalarda sonraki başka bir prosedürün uygulanmasını kolaylaştırır. Ayrıca, genel anestezi gerektirmeden ayakta tedavi endoskopi süitinde gerçekleştirilebilir. Bununla birlikte, tutarsız etkinlik sonuçları göz önüne alındığında, son zamanlarda, çok merkezli bir konsensüs konferansı ve kılavuz belgesi, GÖRH’li yetişkin hastalarda Stretta yerine fundoplikasyonun yararını önermektedir.
Bu tavsiyelerin, devam eden PPI kullanımı yerine Stretta tercihini de içerdiğini vurgulamak önemlidir[5] (Tablo 1).
Genel olarak, Stretta için ideal adaylar, doğrulanmış GÖRH olan, tipik GÖRH semptomları (mide ekşimesi ve/veya regürjitasyon) olan, düşük dereceli erozif özofajit (LA derece A ve B), Barrett özofagusu olmayan, küçük hiatal herni, yetkin bir alt özofagus sfinkteri (LES basıncı >5 mmHg) olan ve PPI tedavisine bir miktar yanıt veren hastaları içerir[51].
Stretta Prosedürünün Geleceği:
GÖRH, tüp mide ameliyatı uygulanan hastalarda sık görülen bir postoperatif istenmeyen olaydır. Fundoplikasyonda olduğu gibi LSG sonrası kalan fundus miktarında anatomik bir sınırlama olmadığı göz önüne alındığında, Stretta bu hasta grubunda potansiyel olarak uygulanabilir. Bu uygulamayı incelemek için klinik çalışmalar devam etmektedir. Bununla birlikte, LSG sonrası 15 hastayı içeren küçük bir çalışmanın raporu, PPI kullanımında azalmaya rağmen GÖRH semptomlarında veya hasta memnuniyetinde iyileşme olmadığını göstermiştir.[52] Bir başka potansiyel araştırma alanı, başarısız laparoskopik Nissen fundoplikasyonu (LNF) olan hastalarda Stretta kullanmaktır. LNF uygulanan hastaların küçük bir alt kümesinde, Stretta subjektif semptomları iyileştirmiştir.[53,54] Kısacası, Stretta’nın cerrahi sonrası kullanımı teknik olarak mümkündür, ancak kavramın kanıtlanması için daha büyük çalışmalara ihtiyaç vardır. Genel olarak, Stretta GÖRH’nin arkasındaki anatomik patolojinin tüm yönlerini ele almamaktadır, bu nedenle kullanımı niş bir popülasyonla sınırlı kalacaktır.
Gastroözofageal Reflü Hastalığında Endoskopik Sütürasyon ve Plikasyon
GÖRH için endoskopik dikiş ve plikasyon teknikleri 1980’lerden bu yana yıllar içinde gelişmiştir.[55] İlk olarak 2008 yılında FDA tarafından onaylanan OverStitch cihazı (Apollo Endosurgery, Austin, TX), esnek bir endoskop aracılığıyla tam kalınlıkta dikişler sağlar. GÖRH için gastroözofageal bileşkenin endoskopik ogmentasyonu da dahil olmak üzere gelişmiş endoskopik prosedürler için çok amaçlı bir cihazdır. Tekniklerin son modifikasyonları, daha iyi doku yapışması için dikiş veya plikasyondan önce mukozal enflamatuar yanıtı içerir. Bunlar şunları içerir:
Mukozal Ablasyon ve EG Kavşağının Dikilmesi: Özofagogastrik bileşkenin (EG) mukozal ablasyonu ve sütürasyonu (MASE) prosedürü, EG bileşiminin altına sütür atmadan önce argon plazma (APC) koagülasyonunu içerir. Pilot çalışmalarda, MASE prosedürünün anatomisi değişmiş hastalarda GÖRH’nin subjektif semptomlarını ve PPI kullanımını iyileştirmede etkili olduğu gösterilmiştir[56,57].
Rezeksiyon ve Plikasyon: Rezeksiyon ve plikasyon (RAP) prosedürü, LES ve kardiyanın tam kalınlıkta plikasyonundan önce mukozal rezeksiyonu içerir. Pilot çalışmalarda, RAP prosedürünün anatomisi değişmiş hastalarda GÖRH’nin subjektif semptomlarını ve PPI kullanımını iyileştirmede etkili olduğu gösterilmiştir.[58,59] 2-3 kesintili sütürden oluşan MASE ile karşılaştırıldığında, RAP prosedürü tek hareketli bir sütür modeli kullanır.
MASE ve RAP prosedürlerinin etkinliğini ve güvenlik profilini belirlemek için daha fazla araştırmaya ihtiyaç vardır. Bu prosedürler öncelikle sınırlı antireflü cerrahi seçenekleri olan değişmiş anatomiye sahip hastalara sunulmaktadır. Zorlu anatomiye sahip bu hasta popülasyonunda retrofleksiyon gerektirmeden prosedürü antegrad olarak gerçekleştirme avantajı sunarlar[45].
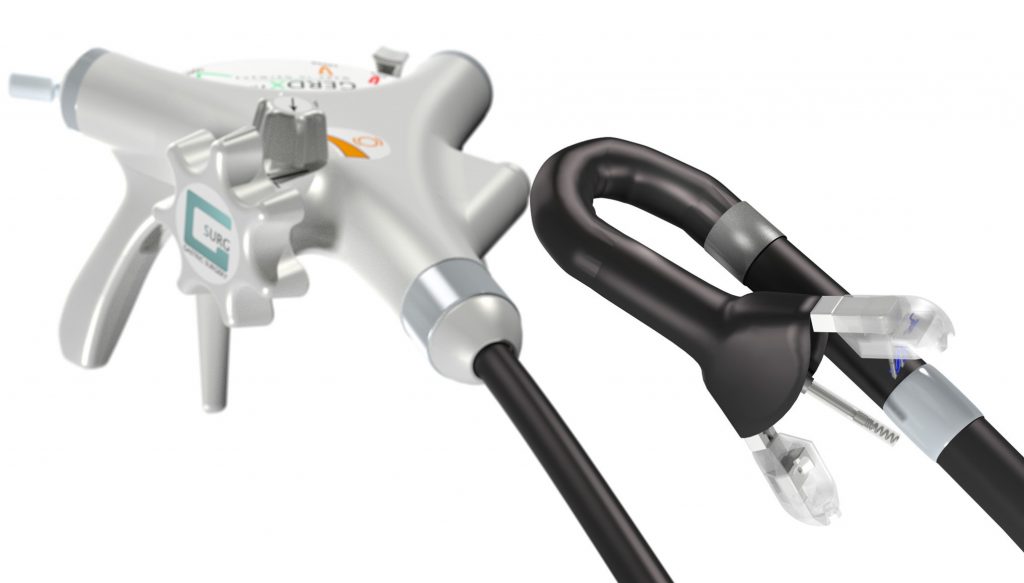
GERDx Cihazı
GERDx cihazı (G-SURG GmbH, Seeon-Seebruck, Almanya) kontrol için bir mikro-hidrolik sistem ve doğrudan görüntüleme için ultra ince bir gastroskop kullanır. Retrofleks pozisyonda sütür uygulaması için bir stapler kullanarak tam kalınlıkta plikasyon üretir. Uzun süreli PPI kullanan GÖRH hastalarında GERDx’in etkinliğini ve güvenliğini değerlendirmek için yakın zamanda tek merkezli, randomize bir plasebo kontrol çalışması yapılmıştır. Birincil son nokta (GERD-HRQL skorunda >%50 iyileşme), 3 ayda sham grubundaki %2,9’a kıyasla müdahale grubundaki hastaların %65,7’sinde elde edilmiştir. 12. ayda, müdahale grubundaki hastaların %62,8’i PPİ’yi bırakırken, bu oran plasebo grupta %11,4’tür. Objektif parametrelerde (24-h-pH impedans çalışması, DeMeester skoru) anlamlı bir fark olmamasına rağmen, çalışma hem 3 hem de 12 aylık aralıklarda hasta merkezli sonuçlarda iyileşme olduğunu ortaya koymuştur. Ayrıca, çalışma sırasında hiçbir ciddi advers olay kaydedilmemiştir ve ortalama prosedür süresi 17,4 (±4) dakika olmuştur.[60] Bu sonuçları desteklemek için uzun süreli takibi olan daha büyük prospektif çalışmalara ihtiyaç vardır.
Antireflü Mukozektomi
Antireflü mukozektomi (ARMS) prosedürü, kardiyadaki neoplastik lezyonlar için mukozektomi uygulanan bazı hastaların beklenmedik bir şekilde reflü semptomlarında iyileşme fark ettikleri gözleminden tesadüfen ortaya çıkmıştır. Bu ilginç keşiften yararlanan Inoue ve arkadaşları[61] hem objektif (DeMeester skoru, 24 saatlik pH empedansı) hem de subjektif (Mide yanması skoru, regürjitasyon skoru) parametrelerde iyileşme gösteren ilk vaka serisini yayınlamıştır. ARMS, GEJ çevresindeki gastrik kardiyanın hemi-sirkumferansiyel rezeksiyonunu içerir, sonuçta oluşan skarlaşma açıklığı azaltır ve gastroözofageal kavşağın genişleyebilme yeteneğini düşürür.[62]
Çeşitli modifikasyonlar (örn, kapak veya bant destekli ARMS) tekniğin daha verimli ve daha kolay uygulanması için önerilmiştir.[63,64] 10 çalışmanın yakın tarihli bir sistematik incelemesi ve meta-analizinde, Garg ve arkadaşları[65] teknik başarı ve klinik yanıt oranını sırasıyla %97,7 [%95 güven aralığı (CI) 94,6-99] ve %80,1 (%95 CI 61,6-91) olarak bulmuştur. ARMS sonrası PPI kullanmayan hastaların havuzlanmış oranı %65,3 (%95 CI 51,4-77) iken, %21,5 (%95 CI 14,2-31,2) PPI kullanımının azaldığını bildirmiştir. Çalışmada ayrıca ARMS sonrası GÖRH’nin hem öznel hem de nesnel parametrelerinde iyileşme bildirilmiştir. En yaygın iki advers olay disfaji/özofageal striktür (%11,4) ve kanamadır (%5). Bu sonuçları değerlendirmek için prospektif çalışmalar devam etmektedir ve bu bulguları daha fazla doğrulamak için uzun süreli takip gereklidir.
Sonuç ve Geleceğe Bakış
Endoskopik tedaviler, uzun süreli tıbbi tedaviden veya daha invaziv cerrahi seçeneklerden kaçınmak isteyen kronik/refrakter GÖRH’li popülasyonun belirli bir alt kümesine minimal invaziv seçenekler sunar. Mevcut seçenekler arasında TIF ve Stretta daha fazla kanıta sahipken, diğerleri geliştirme ve kanıt oluşturma aşamasındadır. (Tablo 1) Bu önemli bir ilerlemeyi temsil etse de, şüphesiz zorluklar devam etmektedir. GÖRH’nin karmaşık patofizyolojisi, belirli prosedürlerin teknik karmaşıklıkları ve dayanıklılığı ve başarı kriterleri üzerinde fikir birliği olmaması, daha geniş çapta benimsenmesini engellemektedir.
İlk olarak, bu zorlukları ele almak için birden fazla GÖRH mekanizmasını hedef alan kombine yaklaşımlar önerilmiştir. İkinci olarak, semptom iyileşmesi ve yaşam kalitesinin değerlendirilmesinde hasta tarafından bildirilen sonuçlar merkezi olmalıdır. Etkinliği değerlendirmek için başarı kriterleri üzerinde bir fikir birliği geliştirmenin yanı sıra, denemeler prosedürün dayanıklılığını belirlemek için uzun süreli takip içermelidir. Son olarak, öğrenme eğrisinin tanımlanması ve antireflü endoskopik prosedürler için eğitim müfredatının oluşturulması önemlidir.
Genel olarak, GÖRH için endoskopik tedavilerin geleceği, yeni tedavilerin kullanıma girmesi ve mevcut tedavilerin daha güvenli ve daha tekrarlanabilir seçeneklere doğru evrilmesi ile umut verici görünmektedir. GÖRH gibi kronik bir hastalıktan muzdarip nüfusun büyük bir alt kümesine hitap etmek için iyi bir konumdadırlar.
Kaynaklar:
- Eusebi LH, Ratnakumaran R, Yuan Y, et al. Global prevalence of, and risk factors for, gastro-oesophageal reflux symptoms: a meta-analysis. Gut 2018; 67:430–440.
- Rettura F, Bronzini F, Campigotto M, et al. Refractory gastroesophageal reflux disease: a management update. Front Med 2021; 8:765061.
- Ciovica R, Gadenstätter M, Klingler A, et al. Quality of life in GERD patients: medical treatment versus antireflux surgery. J Gastrointest Surg 2006; 10:934–939.
- Galmiche JP, Hatlebakk J, Attwood S, et al. Laparoscopic antireflux surgery vs esomeprazole treatment for chronic GERD: the LOTUS randomized clinical trial. JAMA 2011; 305:1969–1977.
- Slater BJ, Collings A, Dirks R, et al. Multisociety consensus conference and guideline on the treatment of gastroesophageal reflux disease (GERD). Surg Endosc 2023; 37:781–806.
** This multisociety guidelines for the treatment of GERD, recommended TIF (moderate certainty of evidence) and Stretta (low certainty of evidence) over continued PPI use in adult patients with GERD. - Katz PO, Dunbar KB, Schnoll-Sussman FH, et al. ACG clinical guideline for the diagnosis and management of gastroesophageal reflux disease. Am J Gastroenterol 2022; 117:27–56.
** This updated ACG guidelines for the diagnosis and management of GERD, incorporated TIF in their recommendations for patients with troublesome regurgitation or heartburn who do not wish to undergo ARS and do not have severe reflux esophagitis (LA grade C or D) or hiatal hernias >2 cm. - Yadlapati R, Gyawali CP, Pandolfino JE, et al. AGA clinical practice update on the personalized approach to the evaluation and management of GERD: expert review. Clin Gastroenterol Hepatol 2022; 20:984–994; e1.
- Weusten BLAM, Barret M, Bredenoord AJ, et al. Endoscopic management of gastrointestinal motility disorders – part 2: European Society of Gastrointestinal Endoscopy (ESGE) Guideline. Endoscopy 2020; 52:600–614.
- Muthusamy VR, Lightdale JR, Acosta RD, et al. The role of endoscopy in the management of GERD. Gastrointest Endosc 2015; 81:1305–1310.
- Gerson L, Stouch B, Lobona° iu A. Transoral incisionless fundoplication (TIF 2.0): a meta-analysis of three randomized, controlled clinical trials. Chir Rom 2018; 113:173–184.
- Trad KS, Barnes WE, Simoni G, et al. Transoral incisionless fundoplication effective in eliminating GERD symptoms in partial responders to proton pump inhibitor therapy at 6 months: the TEMPO randomized clinical trial. Surg Innov 2015; 22:26–40.
- Hunter JG, Kahrilas PJ, Bell RCW, et al. Efficacy of transoral fundoplication vs omeprazole for treatment of regurgitation in a randomized controlled trial. Gastroenterology 2015; 148:324–333; e5.
- Montgomery M, Cadiere GB, Rajan A, et al. Randomised clinical trial: transoral incisionless fundoplication vs. sham intervention to control chronic GERD. Aliment Pharmacol Ther 2015; 42:1261–1270.
- Trad KS, Barnes WE, Prevou ER, et al. The TEMPO trial at 5 years: transoral fundoplication (TIF 2.0) is safe, durable, and cost-effective. Surg Innov 2018; 25:149–157.
- Testoni S, Hassan C, Mazzoleni G, et al. Long-term outcomes of transoral incisionless fundoplication for gastro-esophageal reflux disease: systematic-review and meta-analysis. Endosc Int Open 2021; 09:E239–E246.
- Bell RCW, Mavrelis PG, Barnes WE, et al. A prospective multicenter registry of patients with chronic gastroesophageal reflux disease receiving transoral incisionless fundoplication. J Am Coll Surg 2012; 215:794–809.
- Wilson EB, Barnes WE, Mavrelis PG, et al. The effects of transoral incisionless fundoplication on chronic GERD patients: 12-month prospective multicenter experience. Surg Laparosc Endosc Percutan Tech 2014; 24:36–46.
- Bell RCW, Fox MA, Barnes WE, et al. Univariate and multivariate analyses of preoperative factors influencing symptomatic outcomes of transoral fundoplication. Surg Endosc 2014; 28:2949–2958.
- Bell RCW, Freeman KD. Clinical and pH-metric outcomes of transoral esophagogastric fundoplication for the treatment of gastroesophageal reflux disease. Surg Endosc 2011; 25:1975–1984.
- Trad KS, Turgeon DG, Deljkich E. Long-term outcomes after transoral incisionless fundoplication in patients with GERD and LPR symptoms. Surg Endosc 2012; 26:650–660.
- Barnes WE, Hoddinott KM, Mundy S, Williams M. Transoral incisionless fundoplication offers high patient satisfaction and relief of therapy-resistant typical and atypical symptoms of GERD in community practice. Surg Innov 2011; 18:119–129.
- Ihde GM, Besancon K, Deljkich E. Short-term safety and symptomatic outcomes of transoral incisionless fundoplication with or without hiatal hernia repair in patients with chronic gastroesophageal reflux disease. Am J Surg 2011; 202:740–747.
- Ihde GM, Pena C, Scitern C, Brewer S. pH scores in hiatal repair with transoral incisionless fundoplication. J Soc Laparoendosc Surg 2019; 23:. doi:10.4293/JSLS.2018.00087.
- Huang X, Chen S, Zhao H, et al. Efficacy of transoral incisionless fundoplication (TIF) for the treatment of GERD: a systematic review with meta-analysis. Surg Endosc 2017; 31:1032–1044.
- McCarty TR, Itidiare M, Njei B, Rustagi T. Efficacy of transoral incisionless fundoplication for refractory gastroesophageal reflux disease: a systematic review and meta-analysis. Endoscopy 2018; 50:708–725.
- Haseeb M, Brown JRG, Hayat U, et al. Impact of second-generation transoral incisionless fundoplication on atypical GERD symptoms: a systematic review and meta-analysis. Gastrointest Endosc 2023; 97:394–406; e2.
* This systematic review and meta-analysis reported effectiveness of TIF in reducing subjective symptoms and patient-centered outcomes of population with atypical GERD. - Haseeb M, McCarty TR, Jirapinyo P, Thompson CC. Letter to the editor in response to ACG guidelines for the diagnosis and management of gastroesophageal reflux disease.
- Ihde GM. The evolution of TIF: transoral incisionless fundoplication. Ther Adv Gastroenterol 2020; 13:1–16.
- Richter JE, Kumar A, Lipka S, et al. Efficacy of laparoscopic nissen fundoplication vs transoral incisionless fundoplication or proton pump inhibitors in patients with gastroesophageal reflux disease: a systematic review and network meta-analysis. Gastroenterology 2018; 154:1298–1308; e7.
- Ihde GM, Dill LA, Lister DG, et al. A comparison of the endoscopic and laparoscopic view of the gastroesophageal junction in the use of transoral fundoplication. Am J Surg 2015; 210:1018–1022; discussion 1022–1023.
- Testoni PA, Corsetti M, Di Pietro S, et al. Effect of transoral incisionless fundoplication on symptoms, PPI use, and pH-impedance refluxes of GERD patients. World J Surg 2010; 34:750–757.
- Snow GE, Dbouk M, Akst LM, et al. Response of laryngopharyngeal symptoms to transoral incisionless fundoplication in patients with refractory proven gastroesophageal reflux. Ann Otol Rhinol Laryngol 2022; 131:662–670.
- Choi AY, Roccato MK, Samarasena JB, et al. Novel interdisciplinary approach to GERD: concomitant laparoscopic hiatal hernia repair with transoral incisionless fundoplication. J Am Coll Surg 2021; 232:309–318.
- Janu P, Shughoury AB, Venkat K, et al. Laparoscopic hiatal hernia repair followed by transoral incisionless fundoplication with EsophyX Device (HH +TIF): efficacy and safety in two community hospitals. Surg Innov 2019; 26:675–686.
- Jaruvongvanich VK, Matar R, Reisenauer J, et al. Hiatal hernia repair with transoral incisionless fundoplication versus Nissen fundoplication for gastroesophageal reflux disease: a retrospective study. Endosc Int Open 2023; 11:E11–E18.
** This study compared hiatal hernia repair followed by LNF to cTIF and showed comparable results between the two groups for postprocedural PPI use, dysphagia, esophagitis, disrupted wrap, and hiatal hernia recurrence. In addition, the study found that length of hospital stay, readmission rate, early adverse event rate, serious adverse event rate, and incidence of bloating or worsening of baseline bloating was lower in patients with cTIF compared to HH repair followed by LNF. - Tyberg A, Choi A, Gaidhane M, Kahaleh M. Transoral Incisionless fundoplication for reflux after peroral endoscopic myotomy: a crucial addition to our arsenal. Endosc Int Open 2018; 6:E549.
- Chang KJ. Endoscopic foregut surgery and interventions: the future is now. the state-of-the-art and my personal journey. World J Gastroenterol 2019; 25:1–41.
- Sidwa F, Moore AL, Alligood E, Fisichella PM. Surgical treatment of extraesophageal manifestations of gastroesophageal reflux disease. World J Surg 2017; 41:2566–2571.
- Lechien JR, Dapri G, Dequanter D, et al. Surgical treatment for laryngopharyngeal reflux disease: a systematic review. JAMA Otolaryngol Neck Surg 2019; 145:655–666.
- Chen JW, Vela MF, Peterson KA, Carlson DA. AGA clinical practice update on the diagnosis and management of extraesophageal gastroesophageal reflux disease: expert review. Clin Gastroenterol Hepatol 2023; 21:1414–1421; e3.
- Shah SL, Dawod S, Dawod Q, Sharaiha RZ. Same-session endoscopic sleeve gastroplasty and transoral incisionless fundoplication: a possible solution to a growing problem. VideoGIE 2020; 5:468–469.
- Haseeb M, Thompson CC. Assessing implementation strategy and learning curve for transoral incisionless fundoplication as a new technique. Clin Endosc 2022; 55:751–752.
- Kushner BS, Awad MM, Mikami DJ, et al. Endoscopic treatments for GERD. Ann N Y Acad Sci 2020; 1482:121–129.
- Fernando HC. Endoscopic fundoplication: patient selection and technique. J Vis Surg 2017; 3:121.
- Lee DP, Chang KJ. Endoscopic management of GERD. Dig Dis Sci 2022; 67:1455–1468.
- Sowa P, Samarasena JB. Nonablative radiofrequency treatment for gastroesophageal reflux disease (STRETTA). Gastrointest Endosc Clin N Am 2020; 30:253–265.
- Lipka S, Kumar A, Richter JE. No evidence for efficacy of radiofrequency ablation for treatment of gastroesophageal reflux disease: a systematic review and meta-analysis. Clin Gastroenterol Hepatol 2015; 13:1058–1067; e1.
- Fass R, Cahn F, Scotti DJ, Gregory DA. Systematic review and meta-analysis of controlled and prospective cohort efficacy studies of endoscopic radiofrequency for treatment of gastroesophageal reflux disease. Surg Endosc 2017; 31:4865–4882.
- Noar M, Squires P, Noar E, Lee M. Long-term maintenance effect of radiofrequency energy delivery for refractory GERD: a decade later. Surg Endosc 2014; 28:2323–2333.
- Dughera L, Rotondano G, De Cento M, et al. Durability of Stretta radiofrequency treatment for GERD: results of an 8-year follow-up. Gastroenterol Res Pract 2014; 2014:531907.
- Sandhu DS, Fass R. Stretta therapy in the management of gastroesophageal reflux disease (GERD). Ann Esophagus 2019; 2:. doi:10.21037/aoe.2019.01.01.
- Khidir N, Angrisani L, Al-Qahtani J, et al. Initial Experience of endoscopic radiofrequency waves delivery to the lower esophageal sphincter (Stretta procedure) on symptomatic gastroesophageal reflux disease post-sleeve gastrectomy. Obes Surg 2018; 28:3125–3130.
- Noar MD, Squires P, Khan S. Radiofrequency energy delivery to the lower esophageal sphincter improves gastroesophageal reflux patient-reported outcomes in failed laparoscopic Nissen fundoplication cohort. Surg Endosc 2017; 31:2854–2862.
- McClusky DA, Khaitan L, Swafford VA, Smith CD. Radiofrequency energy delivery to the lower esophageal sphincter (Stretta procedure) in patients with recurrent reflux after antireflux surgery: can surgery be avoided? Surg Endosc Interv Tech 2007; 21:1207–1211.
- Swain CP, Mills TN. An endoscopic sewing machine. Gastrointest Endosc 1986; 32:36–38.
- Fortinsky KJ, Shimizu T, Chin MA, et al. Tu1168 mucosal ablation and suturing at the esophagogastric junction (MASE): a novel procedure for the management of patients with gastroesophageal reflux disease. Gastrointest Endosc 2018; 87:AB552.
- Sowa P, Fortinsky K, Chin M, et al. 356 Mucosal ablation and suturing at the esophagogastric junction (MASE): a novel procedure for the management of gastroesophageal reflux disease in altered anatomy patients. Am J Gastroenterol 2019; 114:S209–S210.
- Walsh PR, Lamba M, Benias P, et al. Feasibility of resection and placation ”RAP” technique for management of medically efractory GERD in patients with altered gastric anatomy. Endosc Int Open 2021; 9:E1549–E1555.
* This study following a pilot study by Benias et al.,[59] showed improvement in subjective symptoms and reduction in PPI usage after RAP in patients with refractory GERD having an altered anatomy after LSG. - Benias PC, D’Souza L, Lan G, et al. Initial experience with a novel resection and plication (RAP) method for acid reflux: a pilot study. Endosc Int Open 2018; 6:E443–E449.
- Kalapala R, Karyampudi A, Nabi Z, et al. Endoscopic full-thickness plication for the treatment of PPI-dependent GERD: results from a randomised, sham controlled trial. Gut 2022; 71:686–694.
* This single-center, randomized sham control trial evaluated efficacy and safety of GERDx in patients with GERD on long-term PPI. The primary endpoint (>50% improvement in GERD-HRQL score) was achieved in 65.7% of patients in the intervention compared to 2.9% in the sham group at 3months. At 12months, 62.8% of patients were off PPI in the intervention group compared with 11.4% in the sham group. Even though there was no significant difference in objective parameters (24-h-pH impedance study, DeMeester score), the study found improvement in patient-centered outcomes at both 3- and 12-month intervals. - Inoue H, Ito H, Ikeda H, et al. Antireflux mucosectomy for gastroesophageal reflux disease in the absence of hiatus hernia: a pilot study. Ann Gastroenterol Q Publ Hell Soc Gastroenterol 2014; 27:346–351.
- Sumi K, Inoue H, Kobayashi Y, et al. Endoscopic treatment of proton pump inhibitor-refractory gastroesophageal reflux disease with antireflux mucosectomy: Experience of 109 cases. Dig Endosc 2021; 33:347–354.
- Yoo IK, Ko WJ, Kim HS, et al. Antireflux mucosectomy using a cap-assisted endoscopic mucosal resection method for refractory gastroesophageal disease: a prospective feasibility study. Surg Endosc 2020; 34:1124–1131.
- Monino L, Gonzalez JM, Vitton V, Barthet M. Antireflux mucosectomy band in treatment of refractory gastroesophageal reflux disease: a pilot study for safety, feasibility and symptom control. Endosc Int Open 2020; 8:E147–E154.
- Garg R, Mohammed A, Singh A, et al. Antireflux mucosectomy for refractory gastroesophageal reflux disease: a systematic review and meta-analysis. Endosc Int Open 2022; 10:E854–E864.
